| Άλφα-αμυλάση | |||||||||
|---|---|---|---|---|---|---|---|---|---|
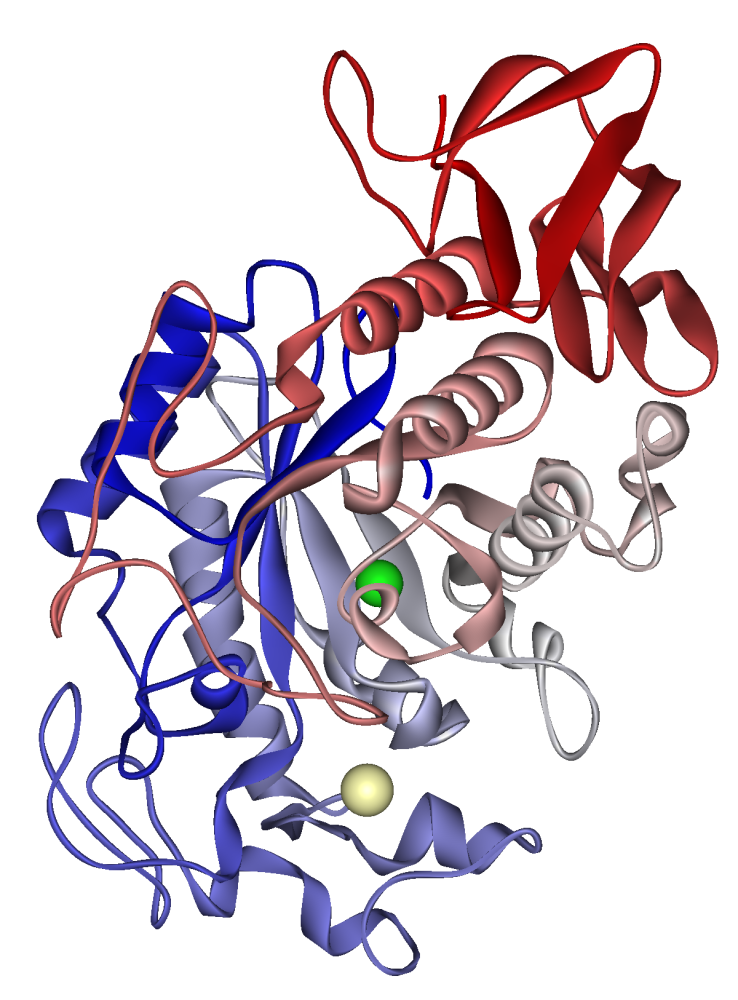
Ανθρώπινη σιελική αμυλάση: ιόν ασβεστίου ορατό σε ανοιχτό χακί, χλωριούχο ιόν σε πράσινο. PDB 1SMD
|
|||||||||
| Αναγνωριστικά | |||||||||
| ΕΚ αριθ. | 3.2.1.0 | ||||||||
| Αριθ. CAS | 9000-90-2 | ||||||||
| Βάσεις δεδομένων | |||||||||
| IntEnz | Προβολή IntEnz | ||||||||
| ΜΠΡΕΝΤΑ | Καταχώριση BRENDA | ||||||||
| ΛΗΞΗ | Προβολή NiceZyme | ||||||||
| KEGG | Καταχώριση KEGG | ||||||||
| MetaCyc | μεταβολική οδός | ||||||||
| ΠΡΙΑΜΟΣ | Προφίλ | ||||||||
| Δομές PDB | RCSB PDB PDBe PDBsum | ||||||||
|
|||||||||
| Καταλυτικός τομέας GH13 | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Κυκλοδεξτρίνη γλυκοτρανσφεράση (ec2.4.1.19) (cgtase)
|
|||||||||
| Αναγνωριστικά | |||||||||
| Σύμβολο | Άλφα-αμυλάση | ||||||||
| Pfam | PF00128 | ||||||||
| Pfam clan | CL0058 | ||||||||
| InterPro | IPR006047 | ||||||||
| ΠΕΔΙΟ2 | 1ppi / SCOPe / SUPFAM | ||||||||
| OPM υπεροικογένεια | 117 | ||||||||
| OPM πρωτεΐνη | 1wza | ||||||||
| ΚΑΛΥ | GH13 | ||||||||
| CDD | cd11338 | ||||||||
|
|||||||||
| Τομέας βήτα-φύλλου άλφα-αμυλάσης C-terminal | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Κρυσταλλική δομή του αδρανούς μεταλλάγματος d180a της α-αμυλάσης κριθαριού ισοένζυμο 1 (amy1) σε σύμπλοκο με μαλτοεπταόζη
|
|||||||||
| Αναγνωριστικά | |||||||||
| Σύμβολο | Άλφα-αμύλ_C2 | ||||||||
| Pfam | PF07821 | ||||||||
| InterPro | IPR012850 | ||||||||
|
|||||||||
| Alpha amylase, C-terminal all-beta domain | |||||||||
|---|---|---|---|---|---|---|---|---|---|
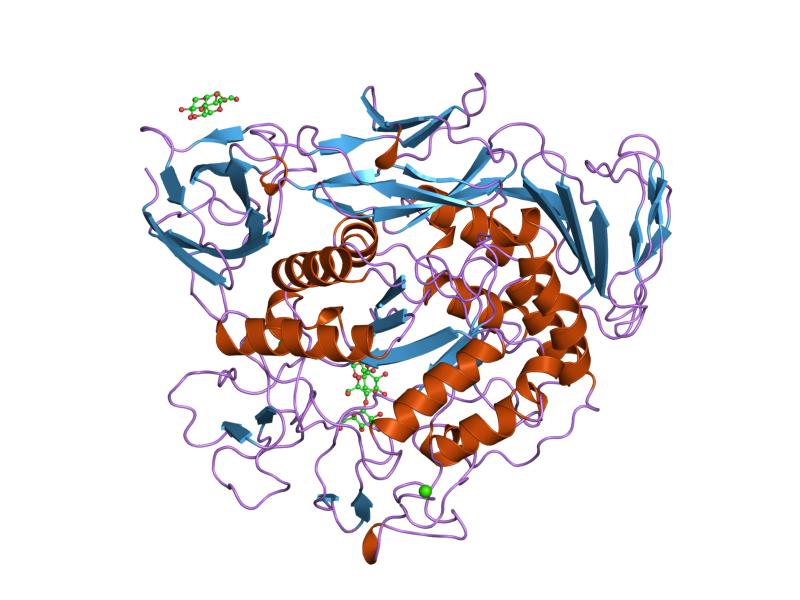
σύμπλοκο μαλτοτριόζης μεταλλαγμένης προκαταρκτικής κυκλοδεξτρίνης γλυκοσυλοτρανσφεράσης
|
|||||||||
| Αναγνωριστικά | |||||||||
| Σύμβολο | Άλφα-αμυλάση_C | ||||||||
| Pfam | PF02806 | ||||||||
| Pfam clan | CL0369 | ||||||||
| InterPro | IPR006048 | ||||||||
| ΠΕΔΙΟ2 | 1ppi / SCOPe / SUPFAM | ||||||||
|
|||||||||
Άλφα-αμυλάση, (α-αμυλάση) είναι ένα ένζυμο EC 3.2.1.1 που υδρολύει άλφα δεσμούς μεγάλων, αλφα-συνδεδεμένων πολυσακχαριτών, όπως άμυλο και γλυκογόνο, αποδίδοντας βραχύτερες αλυσίδες αυτών, δεξτρίνες και μαλτόζη. Είναι η κύρια μορφή αμυλάσης που βρίσκεται σε ανθρώπους και άλλα θηλαστικά. Είναι επίσης παρόν σε σπόρους που περιέχουν άμυλο ως αποθεματικό τροφίμων και εκκρίνεται από πολλούς μύκητες. Είναι μέλος της οικογένειας γλυκόζης υδρολάσης 13.
Στην ανθρώπινη βιολογία
Αν και βρίσκεται σε πολλούς ιστούς, η αμυλάση είναι πιο εμφανής στον παγκρεατικό χυμό και το σάλιο, καθένας από τους οποίους έχει τη δική του ισομορφή της ανθρώπινης α-αμυλάσης. Συμπεριφέρονται διαφορετικά στην ισοηλεκτρική εστίαση και μπορούν επίσης να διαχωριστούν κατά τη δοκιμή χρησιμοποιώντας συγκεκριμένα μονοκλωνικά αντισώματα. Στους ανθρώπους, όλες οι ισομορφές αμυλάσης συνδέονται με το χρωμόσωμα 1p21 (βλέπε ΑΜΥ1Α).
Σιελογόνη αμυλάση (πτυαλίνη)
Η αμυλάση βρίσκεται στο σάλιο και διασπά το άμυλο σε μαλτόζη και δεξτρίνη. Αυτή η μορφή αμυλάσης ονομάζεται επίσης «ptyalin» /ˈταɪəlɪν/, που ονομάστηκε από τον Σουηδό χημικό Jöns Jacob Berzelius. Το όνομα προέρχεται από την ελληνική λέξη πτυω (I spit), επειδή η ουσία προήλθε από το σάλιο. Θα σπάσει μεγάλα, αδιάλυτα μόρια αμύλου σε διαλυτά άμυλα (αμυλοδεξτρίνη, ερυθροδεξτρίνη και αχροδεξτρίνη) παράγοντας διαδοχικά μικρότερα άμυλα και τελικά μαλτόζη. Η πτυαλίνη δρα σε γραμμικούς α (1,4) γλυκοσιδικούς δεσμούς, αλλά η σύνθετη υδρόλυση απαιτεί ένα ένζυμο που δρα σε διακλαδισμένα προϊόντα. Η σιελική αμυλάση απενεργοποιείται στο στομάχι από γαστρικό οξύ. Σε γαστρικό χυμό ρυθμισμένο σε ρΗ 3,3, η πτυαλίνη απενεργοποιήθηκε πλήρως σε 20 λεπτά στους 37 ° C. Αντιθέτως, το 50% της δραστικότητας αμυλάσης παρέμεινε μετά από 150 λεπτά έκθεσης σε γαστρικό χυμό σε ρΗ 4,3. Τόσο το άμυλο, το υπόστρωμα για πτυλίνη, όσο και το προϊόν (βραχείες αλυσίδες γλυκόζης) μπορούν να το προστατεύσουν εν μέρει από την αδρανοποίηση από γαστρικό οξύ. Το Ptyalin που προστέθηκε στο ρυθμιστικό διάλυμα σε ρΗ 3,0 υποβλήθηκε σε πλήρη απενεργοποίηση σε 120 λεπτά. Ωστόσο, η προσθήκη αμύλου σε επίπεδο 0,1% είχε ως αποτέλεσμα το 10% της δραστικότητας που απομένει, και παρόμοια προσθήκη αμύλου σε επίπεδο 1,0% είχε ως αποτέλεσμα περίπου 40% της δραστικότητας να παραμένει στα 120 λεπτά.
Βέλτιστες συνθήκες για πτυαλίνη
- Βέλτιστο pH – 7.0
- Θερμοκρασία ανθρώπινου σώματος
- Παρουσία ορισμένων ανιόντων και ενεργοποιητών:
- Χλωριούχο και βρωμιούχο – πιο αποτελεσματικό
- Ιώδιο – λιγότερο αποτελεσματικό
- Θειικό και φωσφορικό – λιγότερο αποτελεσματικό
Γενετική διακύμανση της ανθρώπινης σιελικής αμυλάσης
Το γονίδιο σιελογόλης αμυλάσης έχει διπλασιαστεί κατά τη διάρκεια της εξέλιξης και οι μελέτες υβριδισμού DNA δείχνουν ότι πολλά άτομα έχουν πολλαπλές διαδοχικές επαναλήψεις του γονιδίου. Ο αριθμός των αντιγράφων γονιδίων συσχετίζεται με τα επίπεδα αμυλάσης σιελογόνων, όπως μετράται με προσδιορισμούς στυπώματος πρωτεΐνης χρησιμοποιώντας αντισώματα έναντι της ανθρώπινης αμυλάσης. Ο αριθμός αντιγράφου γονιδίου σχετίζεται με την φαινομενική εξελικτική έκθεση σε δίαιτες υψηλού αμύλου. Για παράδειγμα, ένα ιαπωνικό άτομο είχε 14 αντίγραφα του γονιδίου αμυλάσης (ένα αλληλόμορφο με 10 αντίγραφα και ένα δεύτερο αλληλόμορφο με τέσσερα αντίγραφα). Η ιαπωνική διατροφή παραδοσιακά περιείχε μεγάλες ποσότητες αμύλου ρυζιού. Αντίθετα, ένα άτομο της Biaka έφερε έξι αντίγραφα (τρία αντίγραφα σε κάθε αλληλόμορφο). Το Biaka είναι κυνηγοί-συλλέκτες τροπικών δασών που παραδοσιακά έχουν καταναλώσει δίαιτα χαμηλής περιεκτικότητας σε άμυλο. Ο Perry και οι συνάδελφοί του υπέθεσαν ότι ο αυξημένος αριθμός αντιγράφων του γονιδίου σιελογόνων αμυλάσης μπορεί να έχει βελτιώσει την επιβίωση που συμπίπτει με τη μετάβαση σε μια διατροφή με άμυλο κατά τη διάρκεια της ανθρώπινης εξέλιξης.
Παγκρεατική αμυλάση
Η παγκρεατική α-αμυλάση διασπά τυχαία τους α (1-4) γλυκοσιδικούς δεσμούς της αμυλόζης για να αποδώσει δεξτρίνη, μαλτόζη ή μαλτροτρόζη. Υιοθετεί έναν μηχανισμό διπλής μετατόπισης με διατήρηση της ανομερούς διαμόρφωσης. Στους ανθρώπους, η σιελική αμυλάση εξελίχθηκε από ένα αντίγραφο αυτής.
Στην παθολογία
Το τεστ για αμυλάση είναι πιο εύκολο να εκτελεστεί από αυτό για τη λιπάση, καθιστώντας το το κύριο τεστ που χρησιμοποιείται για την ανίχνευση και παρακολούθηση της παγκρεατίτιδας. Τα ιατρικά εργαστήρια συνήθως μετρούν είτε την παγκρεατική αμυλάση είτε την ολική αμυλάση. Εάν μετρηθεί μόνο η παγκρεατική αμυλάση, δεν θα παρατηρηθεί αύξηση με παρωτίτιδα ή άλλο τραύμα των σιελογόνων αδένων.
Ωστόσο, λόγω της μικρής ποσότητας που υπάρχει, ο συγχρονισμός είναι κρίσιμος κατά τη δειγματοληψία αίματος για αυτήν τη μέτρηση. Το αίμα πρέπει να λαμβάνεται αμέσως μετά από έναν πόνο παγκρεατίτιδας, αλλιώς εκκρίνεται ταχέως από τα νεφρά.
Η α-αμυλάση των σιελογόνων έχει χρησιμοποιηθεί ως βιοδείκτης για το στρες και ως υποκατάστατος δείκτης της δραστηριότητας του συμπαθητικού νευρικού συστήματος (SNS) που δεν απαιτεί λήψη αίματος.
Ερμηνεία
Αυξημένα επίπεδα πλάσματος στους ανθρώπους βρίσκονται σε:
- Τραύμα του σιελογόνου (συμπεριλαμβανομένης της αναισθητικής διασωλήνωσης)
- Παρωτίτιδα – λόγω φλεγμονής των σιελογόνων αδένων
- Παγκρεατίτιδα – λόγω βλάβης στα κύτταρα που παράγουν αμυλάση
- Νεφρική ανεπάρκεια – λόγω μειωμένης απέκκρισης
Οι συνολικές ενδείξεις αμυλάσης πάνω από 10 φορές το ανώτερο όριο του φυσιολογικού (ULN) υποδηλώνουν παγκρεατίτιδα. Πέντε έως 10 φορές το ULN μπορεί να υποδεικνύει νόσο του ειλεού ή του δωδεκαδακτύλου ή νεφρική ανεπάρκεια και χαμηλότερες αυξήσεις συνήθως παρατηρούνται στη νόσο των σιελογόνων αδένων.
Γονίδια
- σιέλι – ΑΜΥ1Α, AMY1B, AMY1C
- παγκρεατικό – ΑΜΥ2Α, AMY2B
Σε κόκκους
Η δραστικότητα της α-αμυλάσης στους κόκκους μετράται, για παράδειγμα, από τον Hagberg – Perten Falling Number, μια δοκιμή για την εκτίμηση των βλαβών από τα βλαστάρια ή τη μέθοδο Phadebas. Εμφανίζεται στο σιτάρι.
Βιομηχανική χρήση
Η α-αμυλάση χρησιμοποιείται στην παραγωγή αιθανόλης για τη διάσπαση των αμύλων σε κόκκους σε ζυμώσιμα σάκχαρα.
Το πρώτο βήμα στην παραγωγή σιροπιού αραβοσίτου υψηλής φρουκτόζης είναι η επεξεργασία αμύλου αραβοσίτου με α-αμυλάση, παράγοντας βραχύτερες αλυσίδες ολιγοσακχαριτών σακχάρων.
Μια α-αμυλάση που ονομάζεται “Termamyl”, προέρχεται από Bacillus licheniformis, χρησιμοποιείται επίσης σε ορισμένα απορρυπαντικά, ειδικά απορρυπαντικά πλύσης πιάτων και αφαίρεσης αμύλου.
Δείτε την αμυλάση για περισσότερες χρήσεις της οικογένειας αμυλάσης γενικά.
Δυνατότητα για ιατρική χρήση
Η α-αμυλάση έχει επιδείξει αποτελεσματικότητα στην αποικοδόμηση των πολυμικροβιακών βακτηριακών βιοφίλμ με υδρόλυση των α (1-4) γλυκοσιδικών δεσμών εντός των δομικών, εξωπολυσακχαριτών μήτρας της εξωκυτταρικής πολυμερούς ουσίας (EPS).
Αναστολή ρυθμιστικού
Το tris μόριο αναφέρεται ότι αναστέλλει έναν αριθμό βακτηριακών α-αμυλασών, επομένως δεν πρέπει να χρησιμοποιούνται σε ρυθμιστικό διάλυμα tris.
Προσδιορισμός
Διάφορες μέθοδοι είναι διαθέσιμες για τον προσδιορισμό της δραστηριότητας της α-αμυλάσης, και διαφορετικές βιομηχανίες τείνουν να βασίζονται σε διαφορετικές μεθόδους. Η δοκιμή ιωδίου αμύλου, μια εξέλιξη της δοκιμής ιωδίου, βασίζεται στην αλλαγή χρώματος, καθώς η α-αμυλάση αποικοδομεί το άμυλο και χρησιμοποιείται συνήθως σε πολλές εφαρμογές. Μια παρόμοια αλλά βιομηχανικά παραγόμενη δοκιμή είναι η δοκιμή αμυλάσης Phadebas, η οποία χρησιμοποιείται ως ποιοτική και ποσοτική δοκιμή σε πολλές βιομηχανίες, όπως απορρυπαντικά, διάφορα αλεύρια, δημητριακά και βύνη και ιατροδικαστική βιολογία.
Αρχιτεκτονική τομέα
Οι α-αμυλάσες περιέχουν έναν αριθμό διακριτών πρωτεϊνικών περιοχών. Ο καταλυτικός τομέας έχει μια δομή που αποτελείται από ένα οκτακλωνικό άλφα / βήτα βαρέλι που περιέχει την ενεργή τοποθεσία, που διακόπτεται από έναν τομέα δέσμευσης ασβεστίου ~ 70-αμινοξέων που προεξέχει μεταξύ του βήτα κλώνου 3 και της άλφα έλικας 3, και ενός καρβοξυλικού βασικός τομέας beta-barrel. Αρκετές άλφα-αμυλάσες περιέχουν έναν τομέα βήτα-φύλλου, συνήθως στο άκρο C. Αυτός ο τομέας είναι οργανωμένος ως ένα πεντακλωνικό αντιπαράλληλο beta-φύλλο. Αρκετές άλφα-αμυλάσες περιέχουν περιοχή all-beta, συνήθως στο άκρο C.
.














Discussion about this post