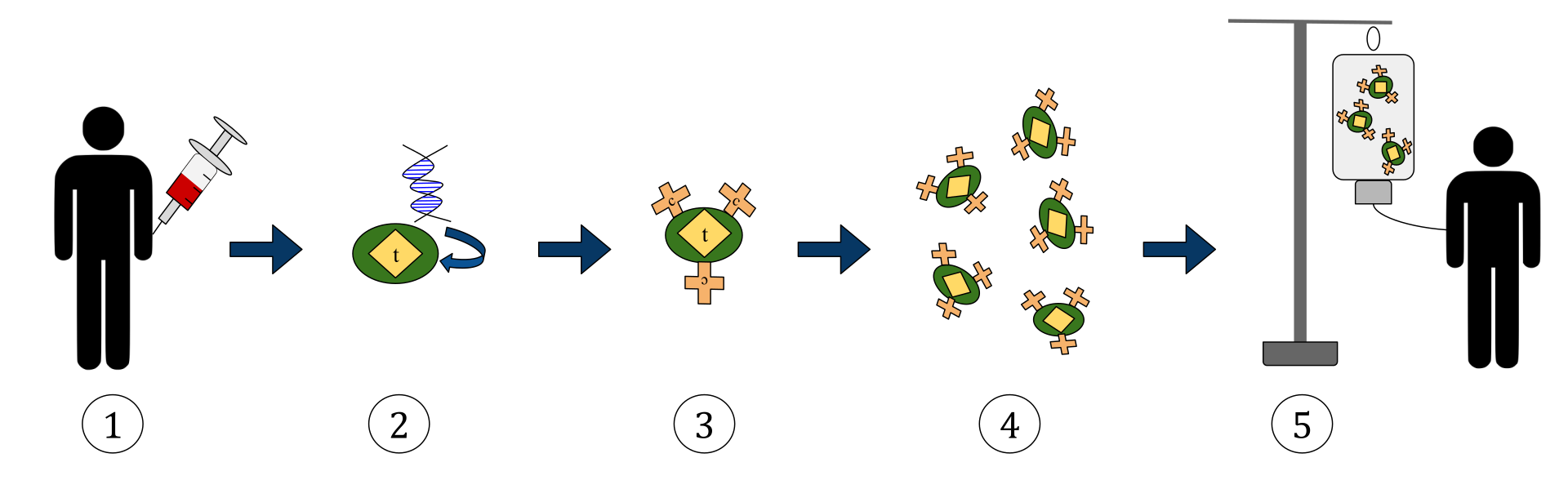
Το παραπάνω διάγραμμα αντιπροσωπεύει τη διαδικασία θεραπείας Τ-κυττάρων χιμαιρικού αντιγόνου υποδοχέα (CAR). Αυτή είναι μια μέθοδος ανοσοθεραπείας, η οποία είναι μια αυξανόμενη πρακτική στη θεραπεία του καρκίνου. Το τελικό αποτέλεσμα θα πρέπει να είναι μια παραγωγή εξοπλισμένων Τ-κυττάρων που μπορούν να αναγνωρίσουν και να καταπολεμήσουν τα μολυσμένα καρκινικά κύτταρα στο σώμα.
1. Τα Τ-κύτταρα (που αντιπροσωπεύονται από αντικείμενα με την ένδειξη «t») αφαιρούνται από το αίμα του ασθενούς.
2. Στη συνέχεια, σε ένα εργαστήριο που ρυθμίζεται το γονίδιο που κωδικοποιεί τους συγκεκριμένους υποδοχείς αντιγόνου ενσωματώνεται στα Τ-κύτταρα.
3. Έτσι παράγονται οι υποδοχείς CAR (επισημαίνονται ως c) στην επιφάνεια των κυττάρων.
4. Τα πρόσφατα τροποποιημένα Τ-κύτταρα συλλέγονται και αναπτύσσονται περαιτέρω στο εργαστήριο.
5. Μετά από ένα ορισμένο χρονικό διάστημα, τα κατασκευασμένα Τ-κύτταρα εγχύονται ξανά στον ασθενή.
Τ κύτταρα χιμαιρικού υποδοχέα αντιγόνου (επίσης γνωστός ως CAR Τ κύτταρα) είναι κύτταρα Τ που έχουν γενετικά τροποποιηθεί για να παράγουν τεχνητό υποδοχέα Τ-κυττάρου για χρήση στην ανοσοθεραπεία.
Χιμαιρικοί υποδοχείς αντιγόνων (ΑΥΤΟΚΙΝΗΤΑ, επίσης γνωστός ως χιμαιρικοί ανοσοϋποδοχείς, υποδοχείς χιμαιρικών Τ κυττάρων, ή τεχνητοί υποδοχείς Τ κυττάρων) είναι πρωτεΐνες υποδοχέων που έχουν σχεδιαστεί για να δώσουν στα Τ κύτταρα τη νέα ικανότητα να στοχεύουν μια συγκεκριμένη πρωτεΐνη. Οι υποδοχείς είναι χιμαιρικοί επειδή συνδυάζουν τόσο λειτουργίες σύνδεσης αντιγόνου όσο και ενεργοποίησης Τ-κυττάρων σε έναν μοναδικό υποδοχέα.
Η θεραπεία κυττάρων CAR-T χρησιμοποιεί Τ κύτταρα κατασκευασμένα με CAR για θεραπεία καρκίνου. Η προϋπόθεση της ανοσοθεραπείας CAR-T είναι να τροποποιήσει τα κύτταρα Τ ώστε να αναγνωρίζουν τα καρκινικά κύτταρα προκειμένου να στοχεύουν και να τα καταστρέφουν αποτελεσματικότερα. Οι επιστήμονες συλλέγουν Τ κύτταρα από ανθρώπους, γενετικά τα αλλάζουν και έπειτα εγχέουν τα προκύπτοντα κύτταρα CAR-T σε ασθενείς για να επιτεθούν στους όγκους τους. Τα κύτταρα CAR-T μπορούν να προέρχονται είτε από Τ κύτταρα στο αίμα ενός ασθενούς (αυτόλογο) είτε να προέρχονται από τα Τ κύτταρα ενός άλλου υγιούς δότη (αλλογενή). Μόλις απομονωθούν από ένα άτομο, αυτά τα Τ κύτταρα γενετικά τροποποιούνται για να εκφράσουν ένα συγκεκριμένο CAR, το οποίο τα προγραμματίζει για να στοχεύσουν ένα αντιγόνο που υπάρχει στην επιφάνεια των όγκων. Για ασφάλεια, τα κύτταρα CAR-T έχουν σχεδιαστεί ώστε να είναι ειδικά για ένα αντιγόνο που εκφράζεται σε έναν όγκο που δεν εκφράζεται σε υγιή κύτταρα.
Αφού τα κύτταρα CAR-T εγχύονται σε έναν ασθενή, δρουν ως «ζωντανό φάρμακο» κατά των καρκινικών κυττάρων. Όταν έρχονται σε επαφή με το στοχευμένο αντιγόνο τους σε ένα κύτταρο, τα κύτταρα CAR-T συνδέονται με αυτό και ενεργοποιούνται, στη συνέχεια προχωρά στον πολλαπλασιασμό και γίνονται κυτταροτοξικά. Τα κύτταρα CAR-T καταστρέφουν τα κύτταρα μέσω πολλών μηχανισμών, συμπεριλαμβανομένου του εκτεταμένου διεγερμένου πολλαπλασιασμού των κυττάρων, αυξάνοντας τον βαθμό στον οποίο είναι τοξικά σε άλλα ζωντανά κύτταρα (κυτταροτοξικότητα) και προκαλώντας την αυξημένη έκκριση παραγόντων που μπορούν να επηρεάσουν άλλα κύτταρα όπως κυτοκίνες, ιντερλευκίνες και αυξητικοί παράγοντες.
Παραγωγή κυττάρων CAR-T

Το πρώτο βήμα στην παραγωγή CAR-T κυττάρων είναι η απομόνωση των Τ κυττάρων από το ανθρώπινο αίμα. Τα κύτταρα CAR-T μπορούν να κατασκευαστούν είτε από το αίμα του ίδιου του ασθενούς, γνωστό ως αυτόλογη θεραπεία, είτε από το αίμα ενός υγιούς δότη, γνωστού ως αλλογενής θεραπείας. Η διαδικασία κατασκευής είναι η ίδια και στις δύο περιπτώσεις. μόνο η επιλογή του αρχικού αιμοδότη είναι διαφορετική.
Πρώτον, τα λευκοκύτταρα απομονώνονται χρησιμοποιώντας διαχωριστή κυττάρων αίματος σε μια διαδικασία γνωστή ως αφαίρεση λευκοκυττάρων. Τα μονοπύρηνα κύτταρα περιφερικού αίματος (PBMC) διαχωρίζονται και συλλέγονται. Τα προϊόντα της αφαίρεσης των λευκοκυττάρων μεταφέρονται στη συνέχεια σε ένα κέντρο επεξεργασίας κυττάρων. Στο κέντρο επεξεργασίας κυττάρων, συγκεκριμένα κύτταρα Τ διεγείρονται έτσι ώστε να πολλαπλασιάζονται ενεργά και να επεκτείνονται σε μεγάλους αριθμούς. Για να οδηγήσουν την επέκτασή τους, τα Τ κύτταρα τυπικά υποβάλλονται σε αγωγή με την κυτοκίνη ιντερλευκίνη 2 (IL-2) και αντι-CD3 αντισώματα.
Τα διογκωμένα Τ κύτταρα καθαρίζονται και μετά μεταγράφονται με ένα γονίδιο που κωδικοποιεί την τροποποιημένη CAR μέσω ενός ρετροϊικού φορέα, τυπικά είτε ενός ενσωματωμένου γάμμα ρετροϊού (RV) είτε ενός φακοϊού (LV) φορέα. Αυτοί οι φορείς είναι πολύ ασφαλείς στη σύγχρονη εποχή λόγω μερικής διαγραφής της περιοχής U3. Το νέο εργαλείο επεξεργασίας γονιδίων CRISPR / Cas9 χρησιμοποιήθηκε πρόσφατα αντί για ρετροϊικούς φορείς για την ενσωμάτωση του γονιδίου CAR σε συγκεκριμένες θέσεις στο γονιδίωμα.
Ο ασθενής υποβάλλεται σε χημειοθεραπεία λεμφοεπιβίβασης πριν από την εισαγωγή των τροποποιημένων κυττάρων CAR-T. Η εξάντληση του αριθμού των κυκλοφορούντων λευκοκυττάρων στον ασθενή ρυθμίζει τον αριθμό των κυτοκινών που παράγονται και μειώνει τον ανταγωνισμό για πόρους, γεγονός που συμβάλλει στην προώθηση της επέκτασης των κατασκευασμένων κυττάρων CAR-T.
Κλινικές εφαρμογές
Από τον Μάρτιο του 2019, υπήρχαν περίπου 364 συνεχιζόμενες κλινικές δοκιμές σε παγκόσμιο επίπεδο που αφορούσαν κύτταρα CAR-T. Η πλειονότητα αυτών των δοκιμών στοχεύουν σε καρκίνο του αίματος: Οι θεραπείες CAR-T αντιπροσωπεύουν περισσότερες από τις μισές από όλες τις δοκιμές για αιματολογικές κακοήθειες. Το CD19 εξακολουθεί να είναι ο πιο δημοφιλής στόχος αντιγόνου, ακολουθούμενος από το BCMA (συνήθως εκφράζεται σε πολλαπλό μυέλωμα). Το 2016, μελέτες άρχισαν να διερευνούν τη βιωσιμότητα άλλων αντιγόνων, όπως το CD20. Οι δοκιμές για συμπαγείς όγκους κυριαρχούνται λιγότερο από το CAR-T, με περίπου τις μισές δοκιμές βασισμένες σε κυτταρική θεραπεία που περιλαμβάνουν άλλες πλατφόρμες όπως τα κύτταρα ΝΚ.
Καρκίνος
Τα Τ κύτταρα είναι γενετικά σχεδιασμένα για να εκφράζουν χιμαιρικούς υποδοχείς αντιγόνων που κατευθύνονται ειδικά προς αντιγόνα στα καρκινικά κύτταρα ενός ασθενούς και στη συνέχεια εγχύονται στον ασθενή όπου επιτίθενται και σκοτώνουν τα καρκινικά κύτταρα. Η θετική μεταφορά Τ κυττάρων που εκφράζουν CAR είναι μια πολλά υποσχόμενη αντικαρκινική θεραπεία Τα τροποποιημένα με CAR Τ κύτταρα μπορούν να κατασκευαστούν ώστε να στοχεύουν σχεδόν οποιοδήποτε αντιγόνο που σχετίζεται με τον όγκο.
Η πρώιμη έρευνα σε κύτταρα CAR-T επικεντρώθηκε στους καρκίνους του αίματος Οι πρώτες εγκεκριμένες θεραπείες χρησιμοποιούν CAR που στοχεύουν το αντιγόνο CD19, που υπάρχουν σε καρκίνους που προέρχονται από Β-κύτταρα όπως οξεία λεμφοβλαστική λευχαιμία (ΟΛΛ) και διάχυτο λέμφωμα μεγάλων Β-κυττάρων (DLBCL). Καταβάλλονται επίσης προσπάθειες για τον σχεδιασμό CAR που στοχεύουν πολλά άλλα αντιγόνα καρκίνου του αίματος, συμπεριλαμβανομένου του CD30 στο πυρίμαχο λέμφωμα του Hodgkin. CD33, CD123 και FLT3 σε οξεία μυελογενή λευχαιμία (AML). και BCMA σε πολλαπλό μυέλωμα.
Οι συμπαγείς όγκοι έχουν παρουσιάσει έναν πιο δύσκολο στόχο. Η αναγνώριση των καλών αντιγόνων ήταν δύσκολη: τέτοια αντιγόνα πρέπει να εκφράζονται σε μεγάλο βαθμό στην πλειονότητα των καρκινικών κυττάρων, αλλά σε μεγάλο βαθμό απουσιάζουν σε φυσιολογικούς ιστούς. Τα κύτταρα CAR-T δεν διακινούνται επίσης αποτελεσματικά στο κέντρο των συμπαγών όγκων, και το εχθρικό μικροπεριβάλλον όγκου καταστέλλει τη δραστηριότητα των Τ κυττάρων.
Αυτοάνοσο νόσημα
Ενώ οι περισσότερες μελέτες CAR T-cell επικεντρώνονται στη δημιουργία ενός CAR T-cell που μπορεί να εξαλείψει έναν ορισμένο κυτταρικό πληθυσμό (για παράδειγμα, CAR T-κύτταρα που στοχεύουν κύτταρα λεμφώματος), υπάρχουν άλλες πιθανές χρήσεις για αυτήν την τεχνολογία. Τα Τ-κύτταρα μπορούν επίσης να προστατεύσουν τα αυτο-αντιγόνα από αυτοάνοσες αντιδράσεις. Ένα ρυθμιστικό Τ-κύτταρο εξοπλισμένο με CAR θα μπορούσε να έχει τη δυνατότητα να παρέχει ανοχή σε ένα συγκεκριμένο αντιγόνο, κάτι που θα μπορούσε να χρησιμοποιηθεί σε μεταμόσχευση οργάνων ή ρευματικές ασθένειες όπως ο λύκος.
Satefy
Υπάρχουν σοβαρές παρενέργειες που προκύπτουν από την εισαγωγή κυττάρων CAR-T στο σώμα, συμπεριλαμβανομένου του συνδρόμου απελευθέρωσης κυτοκίνης και της νευρολογικής τοξικότητας. Επειδή πρόκειται για σχετικά νέα θεραπεία, υπάρχουν λίγα στοιχεία σχετικά με τις μακροπρόθεσμες επιπτώσεις της θεραπείας με CAR-T κυττάρων. Υπάρχουν ακόμη ανησυχίες σχετικά με τη μακροχρόνια επιβίωση των ασθενών, καθώς και επιπλοκές εγκυμοσύνης σε γυναίκες ασθενείς που υποβάλλονται σε θεραπεία με κύτταρα CAR-T. Η αναφυλαξία είναι μια αναμενόμενη παρενέργεια, καθώς το CAR παράγεται με ένα ξένο μονοκλωνικό αντίσωμα και ως αποτέλεσμα, προκαλεί ανοσοαπόκριση.
Η αναγνώριση κατά του στόχου / εκτός όγκου συμβαίνει όταν το CAR-T κύτταρο αναγνωρίζει το σωστό αντιγόνο, αλλά το αντιγόνο εκφράζεται σε υγιή, μη παθογόνο ιστό. Αυτό έχει ως αποτέλεσμα τα κύτταρα CAR-T να προσβάλλουν μη καρκινικούς ιστούς, όπως υγιή Β κύτταρα που εκφράζουν CD19. Η σοβαρότητα αυτής της ανεπιθύμητης ενέργειας μπορεί να ποικίλει από απλασία Β-κυττάρων, η οποία μπορεί να αντιμετωπιστεί με εγχύσεις υποστήριξης, έως ακραία τοξικότητα που οδηγεί σε θάνατο.
Υπάρχει επίσης η απίθανη πιθανότητα τα τροποποιημένα κύτταρα CAR-T να μετατραπούν τα ίδια σε καρκινικά κύτταρα μέσω παρεμβολής μεταλλαξογένεσης, λόγω του ότι ο ιικός φορέας εισάγει το γονίδιο CAR σε καταστολέα όγκου ή ογκογόνο στο γονιδίωμα του κυττάρου Τ ξενιστή. Ορισμένοι φορείς ρετροϊού (RV) ενέχουν μικρότερο κίνδυνο από τους φορείς φακοϊού (LV). Ωστόσο, και οι δύο έχουν τη δυνατότητα να είναι ογκογόνοι. Η γονιδιωματική ανάλυση αλληλουχίας των θέσεων εισαγωγής CAR στα Τ κύτταρα έχει τεκμηριωθεί για καλύτερη κατανόηση της λειτουργίας των κυττάρων Τ CAR και της εμμονής ίη νίνο.
Σύνδρομο απελευθέρωσης κυτοκίνης
Το πιο συνηθισμένο ζήτημα μετά τη θεραπεία με κύτταρα CAR-T είναι το σύνδρομο απελευθέρωσης κυτοκίνης (CRS), μια κατάσταση στην οποία το ανοσοποιητικό σύστημα είναι ενεργοποιημένο και απελευθερώνει αυξημένο αριθμό φλεγμονωδών κυτοκινών. Η κλινική εκδήλωση αυτού του συνδρόμου μοιάζει με σήψη με υψηλό πυρετό, κόπωση, μυαλγία, ναυτία, τριχοειδείς διαρροές, ταχυκαρδία και άλλη καρδιακή δυσλειτουργία, ηπατική ανεπάρκεια και νεφρική ανεπάρκεια. Η CRS εμφανίζεται σε όλους σχεδόν τους ασθενείς που υποβάλλονται σε θεραπεία με CAR-T κυτταρική θεραπεία. Στην πραγματικότητα, η παρουσία του CRS είναι ένας διαγνωστικός δείκτης που δείχνει ότι τα κύτταρα CAR-T λειτουργούν όπως προορίζεται να σκοτώσουν τα καρκινικά κύτταρα. Σημειώστε, ωστόσο, ότι ένας υψηλότερος βαθμός σοβαρότητας CRS δεν σχετίζεται με αυξημένη ανταπόκριση στη θεραπεία, αλλά μάλλον υψηλότερη επιβάρυνση της νόσου.
Νευροτοξικότητα που σχετίζεται με ανοσοποιητικά κύτταρα
Η νευρολογική τοξικότητα συνδέεται επίσης συχνά με τη θεραπεία κυττάρων CAR-T. Ο υποκείμενος μηχανισμός είναι ελάχιστα κατανοητός και μπορεί να σχετίζεται ή όχι με το CRS. Οι κλινικές εκδηλώσεις περιλαμβάνουν παραλήρημα, τη μερική απώλεια της ικανότητας να μιλάμε συνεκτικά, ενώ εξακολουθεί να έχει την ικανότητα να ερμηνεύει τη γλώσσα (εκφραστική αφασία), μειωμένη εγρήγορση (παρεμπόδιση) και επιληπτικές κρίσεις Σε ορισμένες κλινικές δοκιμές έχουν συμβεί θάνατοι που προκαλούνται από νευροτοξικότητα. Η κύρια αιτία θανάτου από νευροτοξικότητα είναι το εγκεφαλικό οίδημα. Σε μια μελέτη που διεξήχθη από την Juno Therapeutics, Inc., πέντε ασθενείς που συμμετείχαν στη δοκιμή πέθαναν ως αποτέλεσμα εγκεφαλικού οιδήματος. Δύο από τους ασθενείς έλαβαν θεραπεία μόνο με κυκλοφωσφαμίδη και οι υπόλοιποι τρεις υποβλήθηκαν σε θεραπεία με συνδυασμό κυκλοφωσφαμίδης και φλουδαραβίνης. Σε μια άλλη κλινική δοκιμή που χρηματοδοτήθηκε από το Fred Hutchinson Cancer Research Center, αναφέρθηκε μια περίπτωση μη αναστρέψιμης και θανατηφόρας νευρολογικής τοξικότητας 122 ημέρες μετά τη χορήγηση των κυττάρων CAR-T.
.













Discussion about this post